-1-
Bestemmelse af vands hÃÂ¥rdhed.
Udstyr og kemikalier.
50 mL mÃÂ¥leglas Pufferopløsning (pH = 10)
10 mL mÃÂ¥leglas 0,0100 M EDTA-opløsning
250 mL konisk kolbe Ionbytter
Burette
Teori
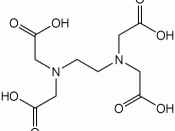
Stoffet EDTA (ethylendiamintetraeddikesyre) er opbygget pÃÂ¥ følgende mÃÂ¥de:
H O O C - C H2 H2 C - C O O H
ú ú
N - C H2 - C H2 - N
ú ú
H O O C - C H2 H2 C - C O O H
Der er tale om en tertaprot syre, men normalt forhandles den i form af dinatriumsaltet, i hvilket to H+ fra syren er udskiftet med Na+.
I tilstrækkelig basisk miljø vil alle 4 H+ være fraspaltet, og vi har derfor følgende ion, der for nemheds skyld blot betegnes EDTA4- :
-O O C - C H2 H2 C - C O O-
ú ú
N - C H2 - C H2 - C H2 - N
ú ú
-O O C - C H2 H2 C - C O O-
Denne ion kan binde sig til mange ioner, fx Zn2+ , Ca2+ og Mg2+ .
I vandværksvand findes afhængig af hÃÂ¥rdheden vekslende mængder af Ca2+ og Mg2+ , der kan bestemmes ved titrering med en EDTA-opløsning med kendt koncentration.
Med Ca2+ som eksempel har vi i basisk opløsning:
Ca2+ + EDTA4- î CaEDTA2-
Som indikator anvendes stoffet eriochromsort-T (Erio-T), der er et organisk farvestof, hvis opbygning ikke har betydning for forstÃÂ¥elsen af titreringen, og som vi derfor blot vil kalde T. Indikatoren er blÃÂ¥ i basisk opløsning, men danner det stærkeste kompleks med indikatoren:
-2-
Mg2+ + T î MgT 2+
Indikatoren tilsættes i forholdsvis ringe mængde, hvorved den binder nogle a Mg2+ i vandværksvandet, og opløsningen bliver rød. Det er vigtigt, at vandet indeholder tilstrækkeligt mange Mg2+ , ellers bliver omslaget nævnt...